Hautchirurgie bei Verletzungen und Defekten der Haut
Die Haut ist unser grösstes Organ. Weltweit leiden Millionen von Menschen an schweren Hautdefekten, welche chirurgisch behandelt werden müssen, um die Funktion der Haut wiederherzustellen. Hautdefekte können akut (Verbrennungen und Traumata) oder elektiv sein (z. B. Narbenkorrekturen, grosse, angeborene Nävi, Tumorresektionen, plastische Chirurgie….).
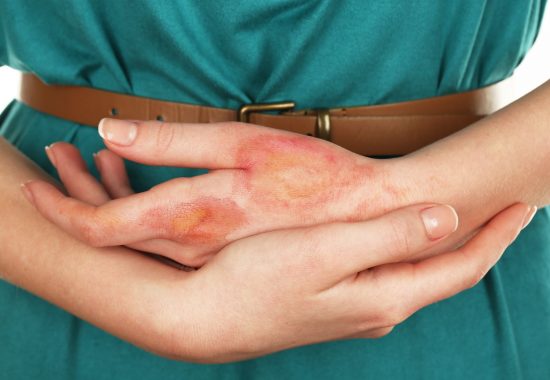
Verbrennungen sind ein globales Problem für die öffentliche Gesundheit und eine der Hauptursachen für Todesfälle oder schwere Behinderungen. Sie sind für schätzungsweise 180’000 Todesfälle pro Jahr verantwortlich. Kinder machen weltweit einen grossen Teil der Menschen mit Brandverletzungen aus und erleiden oft schwere Verletzungen, die einen kritischen und chirurgischen Eingriff erfordern.
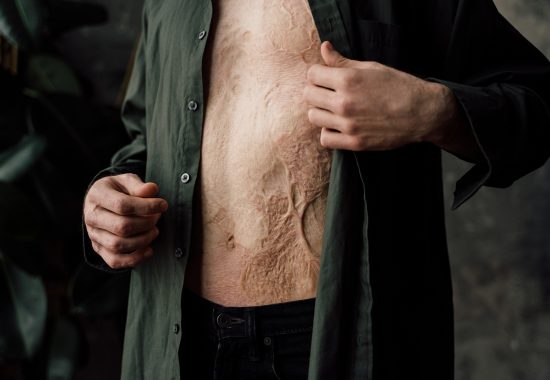
Die derzeitige Standardbehandlung – die Autotransplantation – ist aufgrund des Mangels an Spenderstellen oft nicht in ausreichender Menge verfügbar. Die Haut ist zu dünn und führt zu dauerhaften, schmerzhaften, entstellenden Narben, die häufig durch Folgeoperationen korrigiert werden müssen.
Klinisches Entwicklungsprogramm
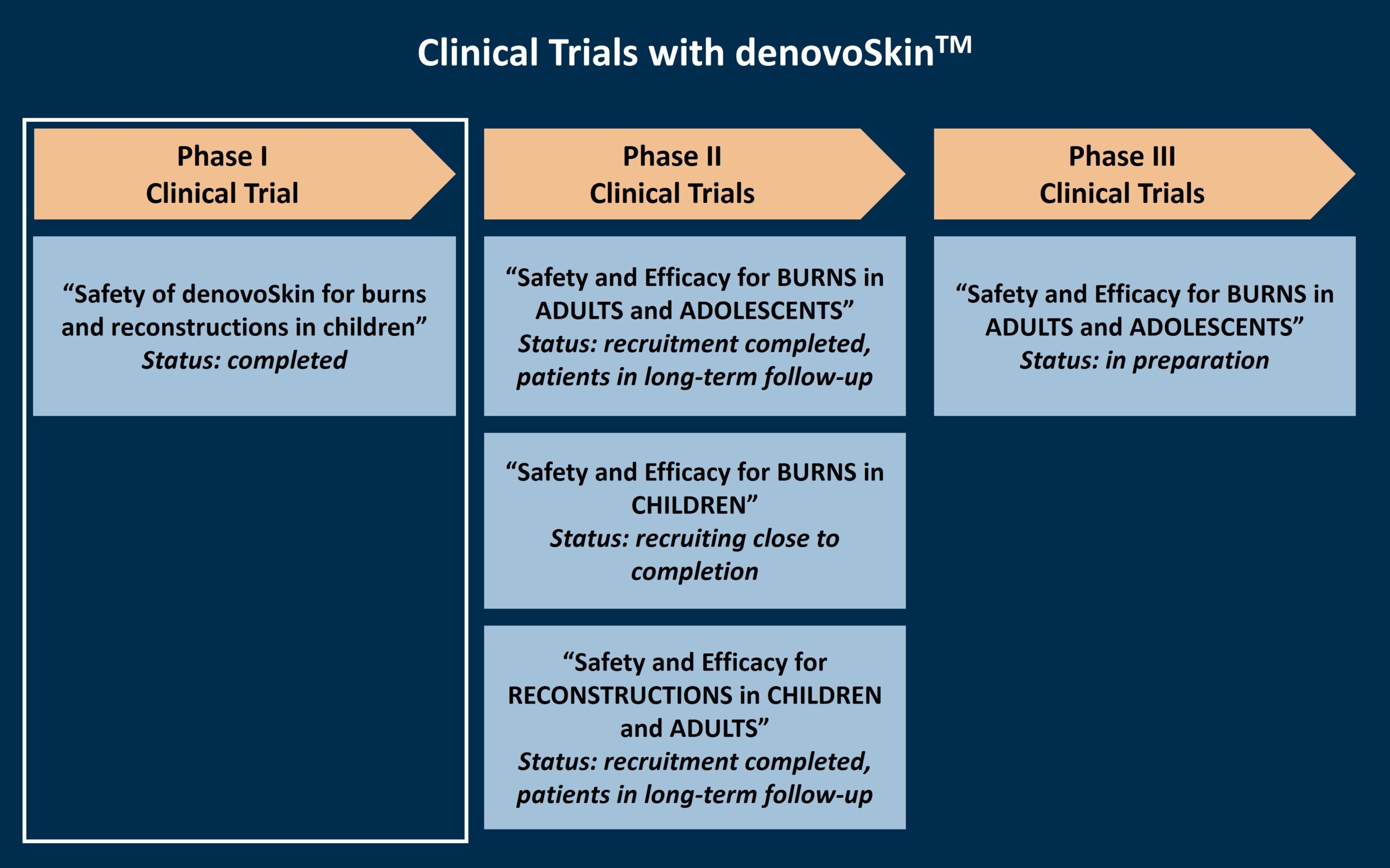
denovoSkin™ wird derzeit bei Verbrennungen und rekonstruktiven Eingriffen bei Kindern und Erwachsenen klinisch getestet.
 PHASE I – SICHERHEITSSTUDIE
PHASE I – SICHERHEITSSTUDIEEine klinische Studie der Phase I für denovoSkin™ wurde mit einer fünfjährigen Nachbeobachtungszeit im Jahr 2021 mit 10 pädiatrischen Patienten am Universitätskinderspital Zürich, Schweiz, abgeschlossen. In dieser Studie wurde die Sicherheit des Produkts bei Kindern und Erwachsenen untersucht, die sich aufgrund von akuten Verbrennungen oder rekonstruktiven Operationen einer Hauttransplantation unterziehen mussten. Ein Bereich der Wunden der Patienten wurde mit maximal einem denovoSkin™ Transplantat behandelt. Die Studie wurde erfolgreich abgeschlossen und bestätigte die Sicherheit des Produkts in dieser ersten klinischen Studie am Menschen.
 PHASE II – SICHERHEITS- UND WIRKSAMKEITSSTUDIEN
PHASE II – SICHERHEITS- UND WIRKSAMKEITSSTUDIENNach dem erfolgreichen Abschluss der klinischen Studie der Phase I wird denovoSkin™ in drei parallel laufenden klinischen Studien der Phase II weiter auf seine Sicherheit und Wirksamkeit untersucht. Diese Studien sind in ihrem Aufbau sehr ähnlich, unterscheiden sich jedoch in der Zusammensetzung der Patientinnen und Patienten und der jeweiligen Anwendung. In allen drei klinischen Studien der Phase II wird denovoSkin™ mit der heutigen Standardbehandlung, der Transplantation von autologer Spalthaut, verglichen. Dazu werden zwei vergleichbare Wundbereiche ausgewählt, von denen einer mit maximal einem denovoSkin™ Transplantat und der andere mit der Standardbehandlung behandelt wird. Während der Studienbesuche werden die beiden Bereiche analysiert und verglichen, insgesamt 3 Jahre lang.
 PHASE III - SICHERHEITS- UND WIRKSAMKEITSSTUDIE
PHASE III - SICHERHEITS- UND WIRKSAMKEITSSTUDIENach dem voraussichtlichen erfolgreichen Abschluss der klinischen Studie der Phase II für denovoSkin™ für Verbrennungen bei Erwachsenen wird eine klinische Studie der Phase III durchgeführt, um die Sicherheit und Wirksamkeit des Produkts weiter zu untersuchen. Diese klinische Studie ist derzeit in Vorbereitung.
BEHANDLUNG IM KONTEXT VON SOGENANNTEN „NAMED-PATIENT BASIS TREATMENT“
Unter besonderen Umständen gibt es eine Behandlungsmöglichkeit, die den Einsatz eines nicht zugelassenen Arzneimittels, wie denovoSkin™ in seinem derzeitigen Entwicklungsstadium, erlaubt. Unter strengen Bedingungen kann denovoSkin™ direkt von CUTISS einem Arzt zur Verfügung gestellt werden, der einen Patienten behandelt, der an einer schweren Erkrankung leidet, für die es keine zufriedenstellenden zugelassenen Therapien gibt und der nicht an klinischen Studien teilnehmen kann. Dies geschieht auf individueller Basis unter der direkten Verantwortung des Arztes.
Wenn Sie als medizinische Fachperson weitere Informationen über eine "Named-Patient Basis Treatment"-Behandlung für Ihre Patienten wünschen, wenden Sie sich bitte an CUTISS.
Unsere klinischen und wissenschaftlichen Publikationen
November 2023
Nature Reviews Disease Primers - Abstract

